基因藥物
基因藥物系列(一)——小核酸藥物
基因藥物通常由含工程化基因構建體的載體或遞送系統組成,其活性成分可為DNA?RNA?基因改造的病毒?細菌或細胞,通過將外源基因導入靶細胞或組織,替代?補償?阻斷?修正特定基因,以達到治療和預防疾病的目的。基因藥物是當今最前沿的藥物開發領域之一,在治療遺傳病、癌癥、糖尿病,預防傳染病等方面正不斷取得突破性進展,主要包括遺傳病治療病毒、溶瘤病毒、基因編輯藥物、mRNA藥物、小核酸藥物等,本文將重點對小核酸藥物進行介紹。
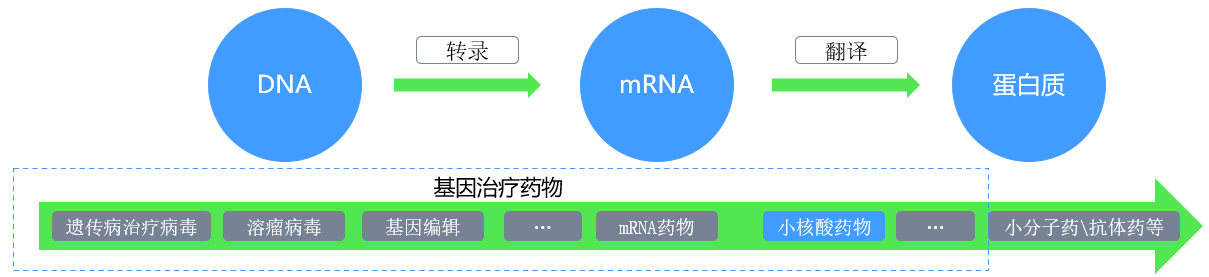
圖:主要基因藥物類型
一、小核酸藥物發展歷程
1978年,哈佛大學科學家Zamecnik等發現用一段互補的核苷酸鏈可以抑制RSV病毒的復制活動,首次提出了反義核酸(Antisense oligonucleotides,ASO)的概念。1998年第一款ASO藥物獲批,同年RNAi(RNA interference,RNA干擾)的作用機理被揭示。3年后,RNAi技術被《Science》雜志評為2001年十大科學進展之一。2006年卡內基研究所的Andrew Fire和馬薩諸塞大學的Craig Mello因發現RNAi機制而獲得諾貝爾醫學或生理學獎。2018年FDA批準首個基于RNAi原理的siRNA藥物。經歷了40余年的發展,小核酸藥物產業化的大幕正在緩緩拉開。
二、新藥研發第三次浪潮
小核酸藥物是與小分子藥物、抗體藥物完全不同的全新藥物類別,其藥物構成為核苷酸序列,藥物機制為作用于mRNA,通過基因沉默抑制靶蛋白的表達,從而實現治療疾病的目的,是生物制藥創新的戰略性前沿領域。
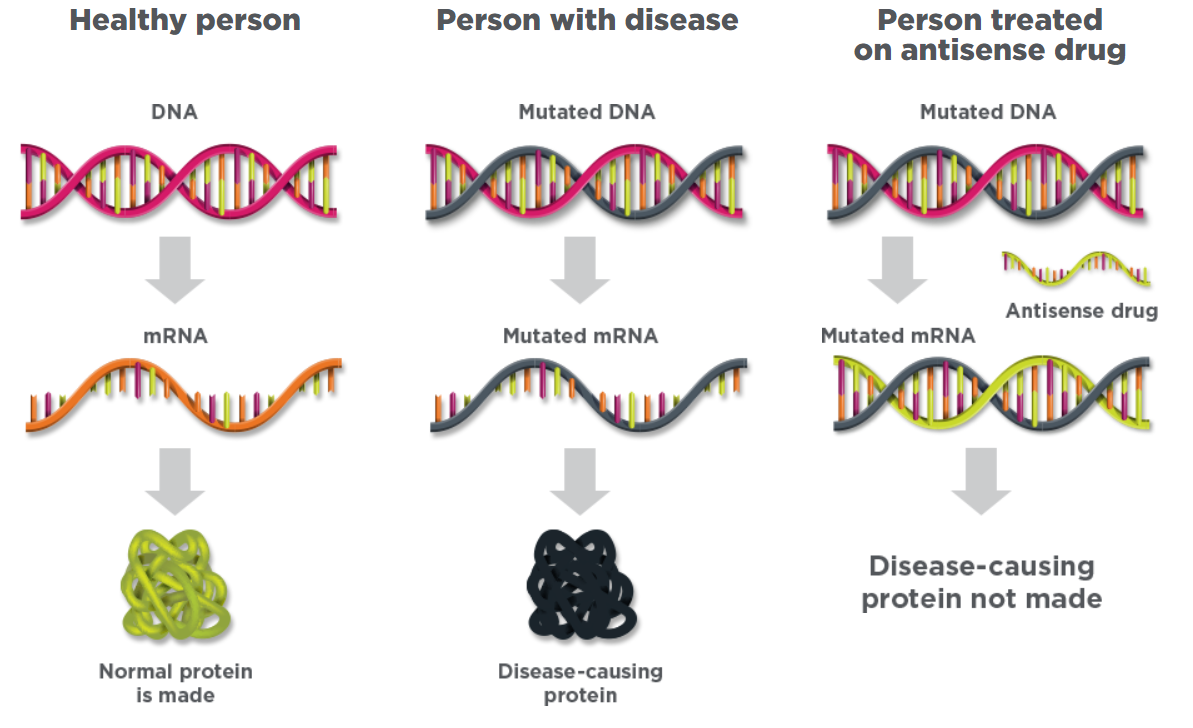
圖:ASO作用原理
資料來源:公開資料整理
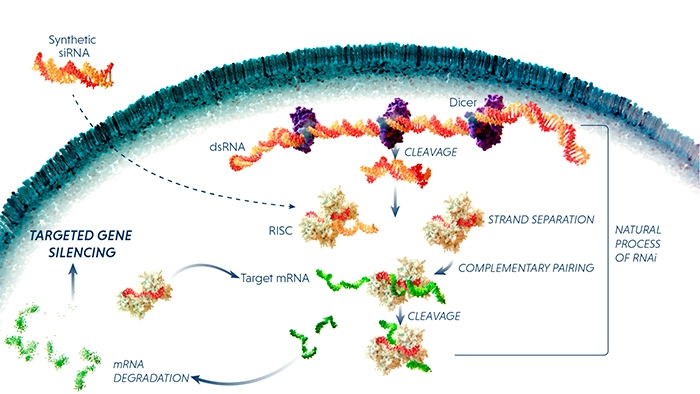
圖:miRNA作用原理
資料來源:公開資料整理
相比抗體藥,核酸藥物研發階段不需要進行復雜蛋白修飾和CMC開發(工藝和質量控制),生產階段制備工藝相對簡單,不需要大規模哺乳動物細胞發酵和蛋白純化,具有候選靶點豐富、研發周期短、藥效持久、臨床開發成功率高等優勢。小核酸藥物從轉錄后水平進行治療,能針對難以成藥的特殊蛋白靶點實現突破,有望攻克尚無藥物治療的疾病包括遺傳疾病和其他難治疾病;具備針對“不可靶向”、“不可成藥”疾病開發出治療藥物的巨大潛力,有望形成繼小分子藥物、抗體藥物之后的現代新藥第三次浪潮。
三、國外企業小核酸藥物研發概況
小核酸藥物主要包括反義核酸(ASO)、小干擾RNA(siRNA)、微小RNA(miRNA)、小激活RNA(saRNA)、信使RNA(mRNA)適配體(aptamer)、核酶(ribozyme)、抗體核酸偶聯藥物(ARC)等。目前全球上市的小核酸藥物共有14款,包括4款siRNA藥物和9款ASO,1款核酸適配體,約80%的產品是2015年以后上市,絕大多數適應癥為遺傳病。Ionis、Alynlam、Sarepta是小核酸藥物三巨頭,擁有豐富的研發管線。
表:全球上市小核酸藥物

資料來源:公開資料整理
Ionis是全球反義核酸藥物研究和開發的領頭羊,基于自身專有的配體共軛反義技術LICA,Ionis建立了豐富的首創藥物和最佳藥物的研發管線,包含超過三十多個在研品種,適應癥覆蓋心血管、代謝、神經、呼吸系統、眼科、癌癥、傳染病等領域。其藥品Spinraza(Nusinersen)在包括美國、中國在內的全球多個國家獲批上市,用于治療兒童和成人的脊髓性肌萎縮(SMA),治療費用高達75萬美元/年,2019年銷售額達21億美元,是全球銷售額最高的小核酸藥物。

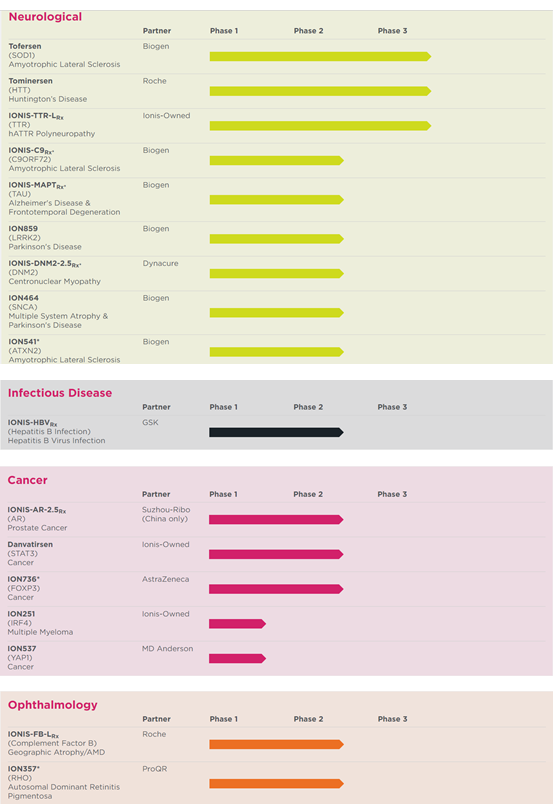

圖:Ionis產品研發管線
資料來源:公開資料整理
Alynlam是全球RNAi藥物的霸主,目前全球上市的4款RNAi藥物全部由Alynlam及其合作伙伴開發。開發安全有效的遞送系統是實現siRNA技術的關鍵,Aynlam在這一領域開發出脂質納米粒子 (Lipid Nanoparticle,LNP)遞送系統平臺和ESC+ GalNAc-siRNA皮下給藥遞送平臺,并于2011年啟動了“Alnylam 5x15”戰略計劃,隨著二代LNP平臺和ESC+ GalNAc-siRNA平臺技術的發展,Alnylam已經開發了一系列候選藥物。據悉除了已獲批的patisiran是采用二代LNP遞送系統之外,其它候選產品均是采用ESC+ GalNAc-siRNA技術開發而成。可見,Alnylam已經將其研發重心轉向皮下給藥方式的GalNAc-siRNA綴合物。
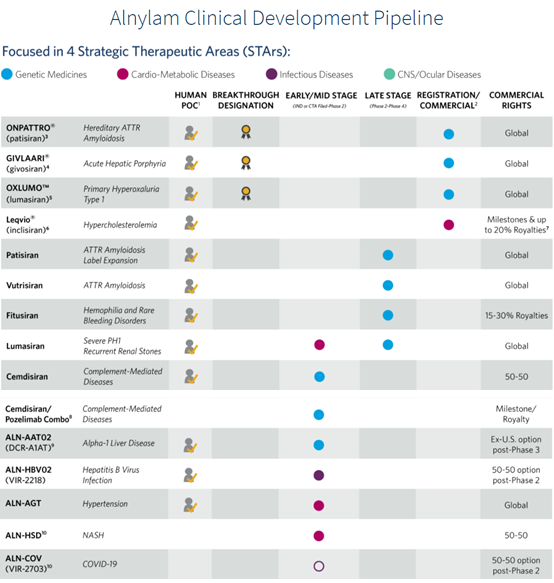
圖:Alynlam產品研發管線
資料來源:公開資料整理
Sarepta公司專注于治療杜興氏肌營養不良癥患者(DMD)與基因治療,目前已有3款ASO藥物獲批上市,10款藥物處于研發階段。該公司的技術平臺使用二氨基磷酸酯嗎啉代寡聚物(PMOs)與外顯子條約技術,讓pre-mRNA在翻譯時跳過發生突變的外顯子,從而產生能夠緩解DMD患者功能缺陷的抗肌萎縮蛋白。該公司的 PMO 技術平臺使用嗎啉(morpholine)代替RNA中的核糖(ribose),這一置換在保持PMO能夠與特定RNA序列正常結合的同時,提高了PMO的穩定性。目前,該公司有多項治療 DMD 的 PMO 療法在 3 期臨床試驗中接受檢驗,用于治療在編碼肌萎縮蛋白的DMD基因不同外顯子上發生變異的患者。
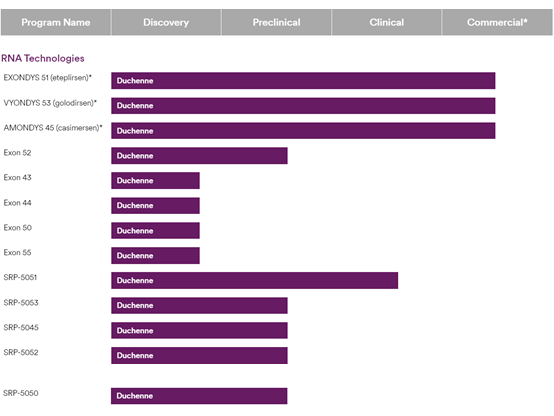
圖:Sarepta產品研發管線
資料來源:公開資料整理
四、國內企業小核酸藥物研發概況
我國僅有一款進口小核酸藥物上市,即Ionis和Biogen合作研發的諾西那生鈉注射液(Nusinersen)。2005年左右,隨著梁子才、陸陽等一批小核酸領域領軍科學家歸國創業,我國小核酸藥物迎來快速發展。目前國內企業研發的小核酸藥物均處于臨床和臨床前研究階段,代表企業有蘇州瑞博、圣諾制藥、舒泰神、西安榮清暢等。
表:國內小核酸藥物代表企業及其專注領域

資料來源:公開資料整理
蘇州瑞博是中國小核酸技術和小核酸制藥的主要開拓者和領軍者,目前公司已經累計獲得超過10億元融資支持,并已經獲得科創版IPO受理。公司對標全球小核酸技術的創新前沿,自主開發并建立了涵蓋小核酸藥物從早期研發到產業化的整個生命周期的全技術鏈整合的小核酸藥物研發平臺,包括小核酸序列設計及高通量篩選平臺、小核酸藥物遞送技術平臺、小核酸穩定化修飾平臺、小核酸藥物生物分析平臺、小核酸藥學研究平臺、小核酸單體研發平臺等六大核心技術平臺,其中自主研發的高效長效GalNAc肝靶向遞送技術達到國際水平。公司采用自主研發和合作研發相結合的產品研發模式,圍繞中國人群的重大臨床需求,形成了包括降血糖、抗前列腺癌、抗視神經損傷、抗乙肝、抗高血脂等多個小核酸藥物在內的在研產品管線。
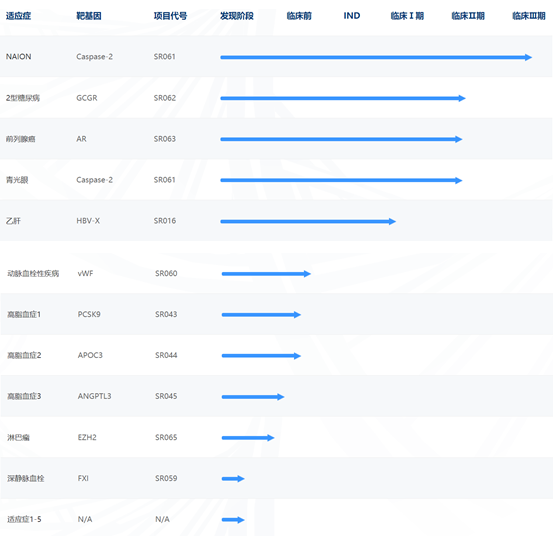
圖:蘇州瑞博產品研發管線
資料來源:公開資料整理
圣諾制藥2019年完成了共計4800萬美元的C輪融資,由廣州的越秀產業基金和香港的華潤正大生命科學基金領投。作為全球領先的專注于核酸干擾(RNAi)藥物研發和產業化開發的生物醫藥企業,以及全球唯一能夠在中美同時推動RNAi臨床研究的研發平臺,圣諾現正在積極推進上市前的新一輪融資的進程,計劃登陸國際資本市場。自成立以來,圣諾已構建了豐富的核酸干擾創新藥物產品線,治療領域覆蓋多項腫瘤和纖維化疾病。其中,與廣州香雪制藥共同開發的領先候選藥物STP705先后獲得了美國FDA和中國藥監局的臨床試驗許可,并且獲得了美國FDA授予的多項孤兒藥資格認定。圣諾制藥獨創了組氨酸-賴氨酸共聚多肽納米顆粒導入技術(PNP)來保護和運送siRNA。PNP由天然氨基酸組成,其降解物天然無毒,同時克服了藥物的靶向性和穩定性障礙。由于PNP可同時攜帶多個siRNA,因此遞送多個siRNA讓其在同一靶向細胞中產生協同的基因沉默效應,可以提高RNAi的藥物療效。
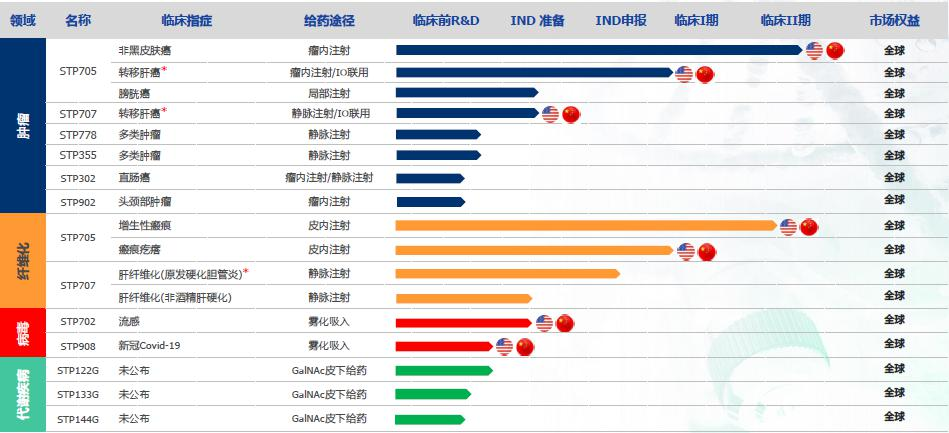
圖:蘇州圣諾產品研發管線(圖)
資料來源:公開資料整理
五、小核酸藥物市場分析
2020年全球小核酸藥物銷售額在30億美元左右。(根據下圖內容,補充個體藥物的銷售情況)雖然小核酸藥物售價昂貴,但由于目前上市的產品主要適應癥為罕見病,針對的患者群體數量有限,小核酸藥物銷售額還未出現爆發式增長。隨著患者群體更廣泛的適應癥藥物開發取得進展,預計2025年全球小核酸藥物銷售額將突破100億美元;到2030年我國小核酸藥物市場也將達到100億元。
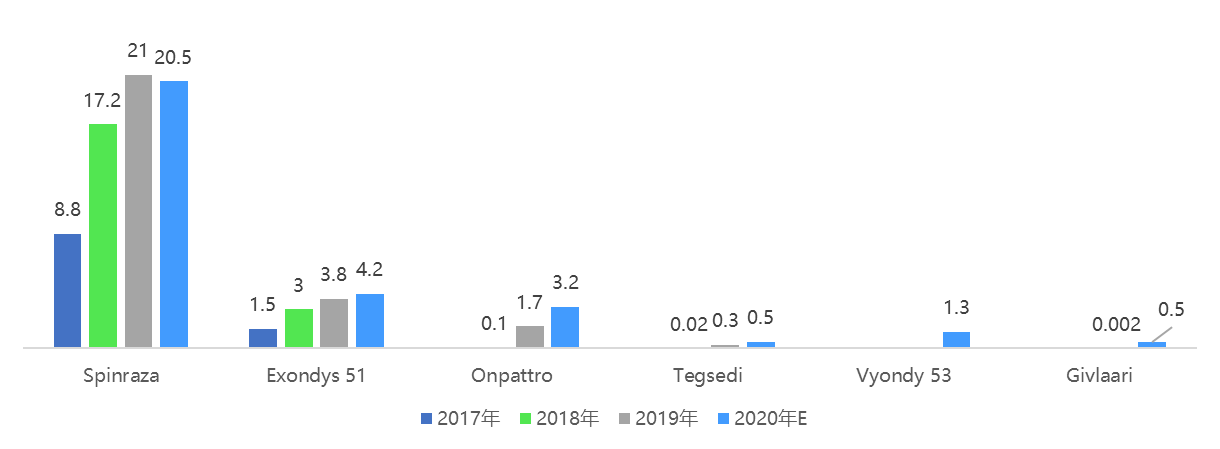
圖:全球小核酸藥物銷售額(億美元)
資料來源:公開資料整理
六、小核酸藥物開發關鍵環節
小核酸原料藥生產使用固相合成技術,在工藝開發、工藝放大和質量控制上存在較高壁壘,小核酸原料藥固相合成配套設備、潔凈環境等前期投入非常大,同時生產需符合 GMP要求。因此,國內有能力生產小核酸原料藥的企業較少,
相關產業配套尚不完善,隨著市場需求的增加,能否保證小核酸藥物的及時供應成為產品開發和商業化成功的重要挑戰。此外,核苷單體是小核酸原料藥的關鍵物料,符合質量要求的核苷單體及時供應是小核酸藥物商業化的關鍵因素。全球僅有為數不多的合格供應商,近年來核酸類藥物和診斷試劑的開發對核苷單體的需求急劇增加。原料藥合成過程中的化學修飾技術和制劑工藝中的遞送技術是小核酸藥物成功最關鍵的因素。小核酸藥物在人體內不穩定,進入血液之后極易被核酸酶降解,且容易通過腎臟清除,半衰期短,同時外源的核酸分子具有免疫原性,容易引起人體的免疫反應。另外,如果不能進入細胞實現胞吞,小核酸藥物將無法發揮作用。通過化學修飾和遞送系統可以解決這些問題。目前國外企業占據了大量LNP和GalNAc-siRNA綴合物技術的專利,國內企業蘇州瑞博和蘇州圣諾等龍頭企業已經成功完成多個不同化學修飾小核酸品種原料藥開發和生產,并相繼研發出具有自主知識產權的遞送技術平臺。
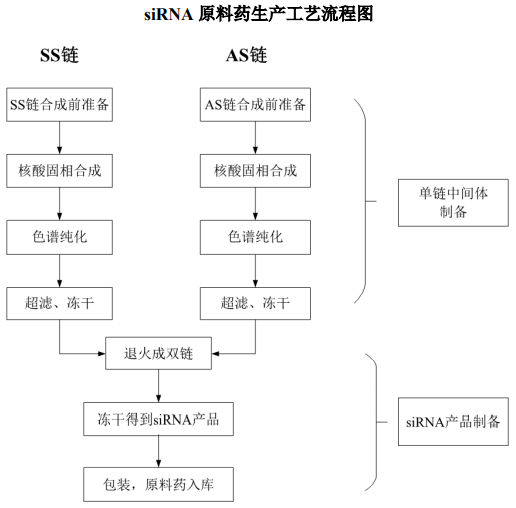
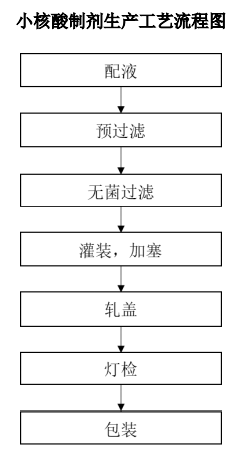
圖:小核酸藥物生產工藝流程圖
資料來源:公開資料整理

